Von Dr. Inge Heinzl, Editor, EW Nutrition
Salmonellose steht an dritter Stelle der lebensmittelbedingten Krankheiten, die zum Tod führen (Ferrari, 2019). Jedes Jahr werden von der EU mehr als 91.000 Salmonellose-Erkrankungen beim Menschen gemeldet, die Gesamtkosten von bis zu 3 Milliarden Euro pro Jahr (EFSA, 2023) verursachen. 10–20 % dieser Erkrankungen sind auf den Konsum von Schweinefleisch zurückzuführen (Soumet, 2022). Die jährlichen Kosten, die sich durch daraus resultierende gesundheitliche Probleme bei Menschen im Jahr 2010 ergaben, beliefen sich auf etwa 90 Millionen Euro (FCC-Konsortium, 2010).
In Irland zum Beispiel stellt das hohe Vorkommen von Salmonellen in den Lymphknoten der Tiere vor der Schlachtung immer noch ein ernstes Problem und damit eine enorme Herausforderung für Schlachthöfe dar, die Prozesshygieneanforderungen einzuhalten (Deane, 2022).
In mehreren Regierungen gibt es bereits Überwachungsprogramme und die Betriebe werden gemäß der Salmonellenbelastung ihrer Schweine kategorisiert. In einigen Ländern, z. B. Dänemark, muss eine Strafe in Höhe von 2 % des Schlachtkörperwerts gezahlt werden, wenn der Betrieb mit 2 (mittlere Seroprävalenz), und 4–8 % wenn er mit 3 eingestuft ist. Andere Länder, z. B. Deutschland, Großbritannien, Irland oder die Niederlande, nutzen Qualitätssicherungssysteme und Landwirte dürfen ihre Schlachtkörper nur dann unter diesem Label verkaufen, wenn ihr Betrieb einem bestimmten Standard entspricht.
Werfen wir einen kurzen Blick auf die Gattung Salmonellen
Salmonellen sind stäbchenförmige gramnegative Bakterien aus der Familie der Enterobakterien, die sich mit Geißeln fortbewegen. Sie sind nach dem amerikanischen Tierarzt Daniel Elmer Salmon benannt. Die Gattung Salmonella besteht aus zwei Arten (S. bongori und S. enterica mit sieben Unterarten) mit insgesamt mehr als 2500 Serovaren (siehe Abbildung 1). Je nach Serovar können die Auswirkung von ‘Krankheitsträger ohne Symptome‘ bis hin zu einer schweren invasiven systemischen Erkrankung reichen (Gal-Mor, 2014). Beim Menschen können grundsätzlich alle Salmonella-Serovare Krankheiten verursachen; die rosafarbenen Exemplare verursachten bereits Infektionen.
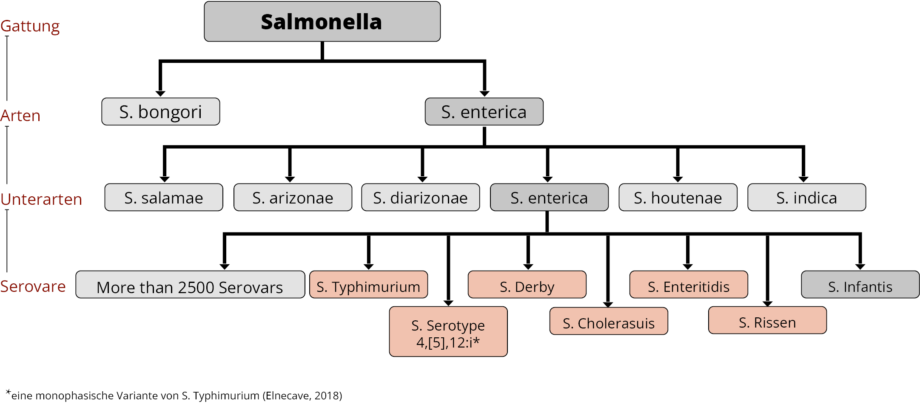
Innerhalb der Gruppe der Salmonellen können einige Serovare nur bei einer oder wenigen Tierarten vorkommen, z. B. S. enterica spp. enterica Serovar Dublin (S. Dublin) bei Rindern (Waldron, 2018) oder S. Cholerasuis bei Schweinen (Chiu, 2004). Eine Infektion des Menschen mit diesen Erregern ist oft invasiv und lebensbedrohlich (WHO, 2018). Im Gegensatz dazu sind Serovare wie S. Typhimurium und S. Enteritidis nicht wirtsspezifisch und können bei verschiedenen Arten Krankheiten verursachen.
Die Serotypen S. Typhi und S. Paratyphi A, B oder C sind stark an Menschen angepasst und nur für sie pathogen; sie sind für die Entstehung von Typhus verantwortlich.
Bei Schweinen vorkommende und für den Menschen relevante Serovare sind beispielsweise S. Typhimurium (Hendriksen, 2004), S. Serotyp 4,[5],12:I (Hauser et al., 2010), S. Cholerasuis (Chiu, 2004), S. Derby (Gonzalez-Santamarina, 2021), S. Agona (Brenner Michael, 2006) und S. Rissen (Elbediwi, 2021).
Übertragung von Salmonellen erfolgt meist über kontaminierte Lebensmittel
Der Übertragungsweg von Salmonellen auf den Menschen hängt vom Serovar ab:
Die menschenspezifischen und daher nur bei Menschen und höheren Primaten vorkommenden Serovare S. Typhi und Paratyphi A, B oder C (typhoidal) werden über Kot oder Urin ausgeschieden. Daher kann jedes Lebensmittel oder Wasser, das mit dem Kot oder Urin infizierter Personen kontaminiert ist, diese Krankheit übertragen (Regierung von Südaustralien, 2023). Typhus und Paratyphus kommen endemisch in Entwicklungsländern vor, in denen es an sauberem Wasser und damit an ausreichender Hygiene mangelt (Gal-Mor, 2014).
Serovare, die bei Menschen und Tieren Krankheiten verursachen können (nicht-typhoidal), können übertragen werden durch
- tierische Produkte wie Milch, Eier, Fleisch
- Kontakt mit infizierten Personen/Tieren (Schweine, Kühe, Haustiere, Reptilien…) oder
- andere mit Kot oder Urin kontaminierte Produkte wie Sprossen, Gemüse, Obst….
Nutztiere nehmen Salmonellen von Artgenossen, kontaminiertem Futter oder Wasser, Nagetieren oder Schädlingen auf.
Auswirkungen einer Salmonellose können gravierend sein
Bei Typhus- oder Paratyphus kann die Krankheit in verschiedenen Stufen verlaufen. Menschen können unter anhaltend hohem Fieber, Unwohlsein, starken Kopfschmerzen und vermindertem Appetit leiden, aber auch unter einer vergrößerten Milz, verbunden mit Unterleibsschmerzen oder trockenem Husten.
Eine in Thailand durchgeführte Studie mit Kindern, die an durch die Serovare S. Typhi und Paratyphi verursachtem Typhus litten, zeigte einen plötzlichen Beginn von Fieber und Magen-Darm-Problemen (Durchfall), Rosenflecken, Bronchitis und Lungenentzündung (Thisyakorn et al., 1987).
Die nicht-typhusartige Salmonellose ist typischerweise durch einen akuten Beginn von Fieber, Übelkeit, Bauchschmerzen mit Durchfall und manchmal Erbrechen gekennzeichnet (WHO, 2018). Allerdings können 5 % der Personen anfällig für eine Bakteriämie (Vorhandensein der Bakterien im Blutkreislauf) sein. Zu diesen Personen zählen Kinder mit Grunderkrankungen, z. B. Babys, oder Menschen, die an AIDS, bösartigen Erkrankungen, entzündlichen Darmerkrankungen, Magen-Darm-Erkrankungen durch Nicht-Typhus-Serovare und hämolytischer Anämie leiden oder eine immunsuppressive Therapie erhalten. Auch Serovare wie S. Cholerasuis oder S. Dublin können eine Bakteriämie entwickeln, indem sie direkt in den Blutkreislauf gelangen und den Darm kaum oder gar nicht befallen (Chiu, 1999). In diesen Fällen können die Folgen septische Arthritis, Lungenentzündung, Peritonitis, Hautabszesse, ein mykotisches Aneurysma und manchmal der Tod sein (Chen et al., 2007; Chiu, 2004, Wang et al., 1996).
Bei Schweinen verursacht S. Choleraesuis hohes Fieber, violette Verfärbungen der Haut und nachfolgend Durchfall. Die Sterblichkeitsrate bei Schweinen, die an dieser Art von Salmonellose leiden, ist hoch. Börge, die oral mit S. Typhimurium infiziert wurden, zeigten 12 Stunden nach der Infektion bis zum Ende der Studie eine erhöhte Rektaltemperatur. Die Futteraufnahme nahm bis zu einem Tiefstwert bei 48 Stunden nach der Infektion ab und blieb bis zu 120 Stunden nach der Infektion niedrig. In den auf die Infektion folgenden zwei Wochen verringerten sich die täglichen Zunahmen. Weiterhin konnte ein höherer Cortisolspiegel im Plasma und ein niedrigerer IGF-I-Spiegel festgestellt werden. Alle diese Effekte deuten auf signifikante Reaktionen der endokrinen Stress- und der somatotropen Achse hin, auch wenn die Veränderungen bei den systemischen proinflammatorischen Mediatoren nicht signifikant sind (Balaji et al., 2000).
Menschen schützen durch Minimierung von Salmonellen im Schweinefleisch!
Um die Kontamination von Schweinefleisch so gering wie möglich zu halten, sind drei Schritte notwendig:
- Salmonellen möglichst vom Schweinebetrieb fernhalten!
- wenn Salmonellen bereits auf dem Betrieb vorhanden sind, Ausbreitung unbedingt vermeiden!
- Kontamination im Schlachthof vermeiden!
1. Wie schützt man den Betrieb vor Salmonellen?
Um diese Frage zu beantworten, müssen wir uns ansehen, wie die Erreger in den Betrieb transportiert werden können. Gemäß dem „Code of Practice for the Prevention and Control of Salmonella on Pig Farms“ (Ministerium für Landwirtschaft, Fischerei und Ernährung und Schottisches Ministerium für Ländliche Angelegenheiten) gibt es mehrere Möglichkeiten, den Erreger in den Betrieb einzuschleusen:
- Zukauf von offensichtlich erkrankten Schweinen oder Schweinen, die krank sind, aber keine Symptome zeigen
- Verunreinigte Futtermittel oder Einstreu
- Haustiere, Nagetiere, Wildvögel oder Wildtiere
- Betriebspersonal oder Besucher
- Gerätschaften oder Fahrzeuge
Vorsicht bei zugekauften Tieren!
Um den Eintrag von Salmonellen in den Viehbestand zu minimieren bzw. zu verhindern, müssen zugekaufte Tiere aus angesehenen Zuchtbetrieben, die über ein Salmonellenüberwachungssystem verfügen, stammen. Mögliche Trägertiere neigen bei Stress dazu, Salmonellen auszuscheiden und sollten nach dem Kauf erst einmal in Quarantäne kommen. Zusätzlich müssen die Tiere vor dem Betreten des Betriebs ein Desinfektionsbad durchlaufen.
Halten Sie Nagetiere, Wildtiere und Ungeziefer in Schach!
Generell gilt, dass der Produktionsstandort für all diese Tiere sauber und möglichst unattraktiv gehalten werden sollte. Futterreste müssen entfernt, tote Tiere und Nachgeburten umgehend und sorgfältig entsorgt werden. Zur wirksamen Bekämpfung von Nagetieren sollte eine gut geplante Köder- und Fangstrategie vorhanden sein.
Nur ausgewählte Personen dürfen in die Schweineställe
In jedem Fall sollten so wenige Personen wie möglich den Schweinestall betreten. Das Betriebspersonal sollte in den Hygienegrundsätzen geschult werden. Angemessene Kleidung (wasserdichte Stiefel und Schutzoverall), die leicht gereinigt/gewaschen und desinfiziert werden kann, ist essenziell. Kleidung und Schuhe sollten stets nur an einem Standort verwendet werden. Gründliches Händewaschen und die Desinfektion der Stiefel beim Betreten und Verlassen des Schweinestalls sind ein Muss.
Wenn Besuche notwendig sind, gelten für die Besucher die gleichen Regeln wie für das Betriebspersonal. Und natürlich dürfen sie in den letzten 48 Stunden keinen Kontakt zu einem anderen Schweinebetrieb gehabt haben.
Halten Sie Ställe, landwirtschaftliche Geräte und Fahrzeuge sauber!
Landmaschinen sollten möglichst nicht mit anderen landwirtschaftlichen Betrieben geteilt werden. Lässt sich dies nicht vermeiden, müssen die Maschinen gründlich gereinigt und desinfiziert werden, bevor sie auf den Betrieb zurückkommen. Auch die Fahrzeuge zum Transport der Tiere müssen schnellstmöglich nach der Nutzung gereinigt und desinfiziert werden, da kontaminierte Transporter immer ein Infektionsrisiko darstellen.
Futter sollte unbedingt salmonellenfrei sein!
Um qualitativ hochwertiges und salmonellenfreies Futter zu bekommen, sollte es von Futtermühlen/Herkünften bezogen werden, die das Futter verantwortungsvoll hinsichtlich Bakterien kontrollieren.
Auf dem Betrieb ist es wichtig, dass Vögel, Haus- und Wildtiere nicht in die Futterlager gelangen. Trockenfutter sollte entsprechend und gut trocken gelagert werden, da eventuell vorhandene Salmonellen sich bei feuchten Bedingungen vermehren können. Die Reinigung aller Futterbehälter und Förderleitungen für Trocken- und Nassfutter sowie die Desinfektion der Nassfutterleitungen sollten selbstverständlich sein. Eventuell denken Sie über einen Wechsel von pelletiertem zu nicht-pelletiertem Futter nach, da Pellets die Sekretion von Muzinen stimulieren und damit die Ansiedlung von Salmonellen fördern (Hedemann et al., 2005).
Um die pathogene Belastung in Futtermitteln zu verringern, bieten wir für die Futterhygiene organische Säuren (Acidomix-Produktreihe) an. In Ländern in denen Formaldehydprodukte zugelassen sind, können Sie auch auf unsere Mischungen aus organischen Säuren und Formaldehyd (Formycine) zugreifen. In-vitro-Studien zeigen die Wirksamkeit der Produkte:
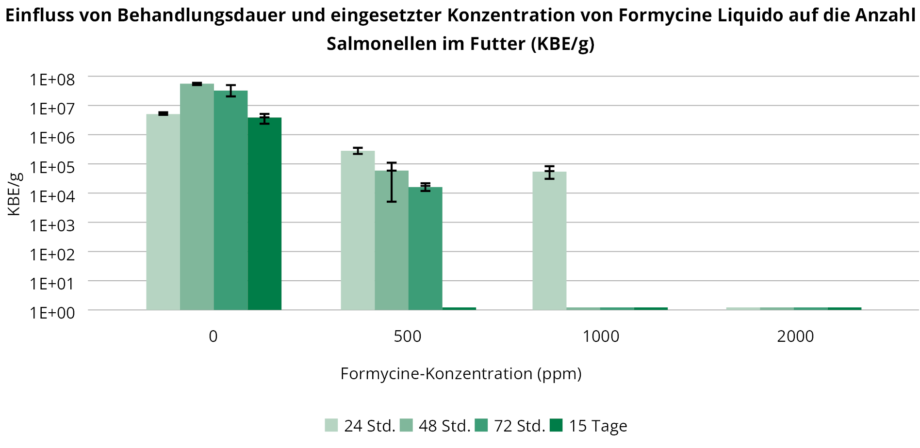
Für einen In-vitro-Versuch mit Formycine wurden autoklavierte Futterproben mit Salmonella enteritidis Serovar Typhimurium DSM 19587 beimpft, um eine Salmonellenkontamination von 106 KBE/g Futter zu erzielen. Nach dreistündiger Inkubation bei Raumtemperatur wurde den kontaminierten Futterproben Formycine Liquido in Konzentrationen von 0, 500, 1000 und 2000 ppm zugesetzt. Kontrollen und beimpfte Futterproben wurden weiter bei Raumtemperatur inkubiert und die Salmonellen (KBE/g) nach 24, 48, 72 Stunden und am 15. Tag gezählt.
Die Nachweisgrenze für Salmonellen wurde auf 100 KBE/g (102) festgelegt. Die Ergebnisse sind in Abbildung 2 dargestellt.
Ebenso wichtig wie unbelastetes Futter ist sauberes Trinkwasser. Dies kann durch die Entnahme des Wassers aus der normalen Trinkwasserleitung oder einem bakteriologisch kontrollierten Brunnen erreicht werden. Eine regelmäßige Reinigung/Desinfektion der Tanks, Leitungen und Tränken ist unerlässlich.
Einstreumaterial sollte salmonellenfrei sein!
Einstreumaterial, das mit dem Kot anderer Tiere (Nagetiere, Haustiere) verunreinigt ist, birgt immer das Risiko einer Salmonellenkontamination. Auch nasse oder schimmelige Einstreu ist nicht zu empfehlen, da sie eine zusätzliche Belastung für die Tiere darstellt. Um die Qualität der Einstreu zu optimieren, sollte das Stroh o.ä. aus zuverlässigen und möglichst wenigen Quellen bezogen werden. Das Material muss trocken und so weit wie möglich von den Schweineställen entfernt gelagert werden (Ministerium für Landwirtschaft, Fischerei und Ernährung und Schottisches Ministerium für Ländliche Angelegenheiten).
Zur Bekämpfung von Salmonellen in Schweinebeständen ist die Impfung ein wirksames Mittel. De Ridder et al. (2013) zeigten eine reduzierte Übertragung von Salmonella Typhimurium bei Schweinen durch den Einsatz eines attenuierten Impfstoffs. Die Impfung mit einem abgeschwächten S. Typhimurium-Stamm gefolgt von einer Auffrischungsimpfung mit inaktiviertem S. Cholerasuis zeigte bessere Wirkung als ein inaktivierter S. Cholerasuis-Impfstoff allein (Alborali et al., 2017). Durch eine geringere Ausscheidung von Salmonellen konnte in einem Versuch von Bearson et al. (2017) die Krankheitsübertragung reduziert und die Tiere vor einer systemischen Erkrankung geschützt werden.
Um die erfolgversprechendste Impfstrategie wählen zu können und damit die besten Effekte zu erzielen, muss der Schweinehalter die Vielfalt der Salmonellen-Serovare verstehen (FSIS, 2023).
2. Wie kann die Ausbreitung von Salmonellen auf dem Betrieb minimiert werden?
Sind bereits Salmonella-Fälle auf dem Betrieb bekannt, müssen die infizierten Tiere vom Rest des Bestandes getrennt werden. Vorteilhaft ist, kleine Gruppen zu haben und unterschiedliche Würfe nach dem Absetzen nicht zu mischen. Wenn machbar, könnten separate Einheiten für verschiedene Produktionsphasen mit einem Rein-Raus-System den Reinfektionszyklus durchbrechen und dazu beitragen, die Salmonellenkontamination auf dem Betrieb zu reduzieren. Auch in diesem Fall ist eine Impfung hilfreich.
Salmonellen mögen es nicht sauer
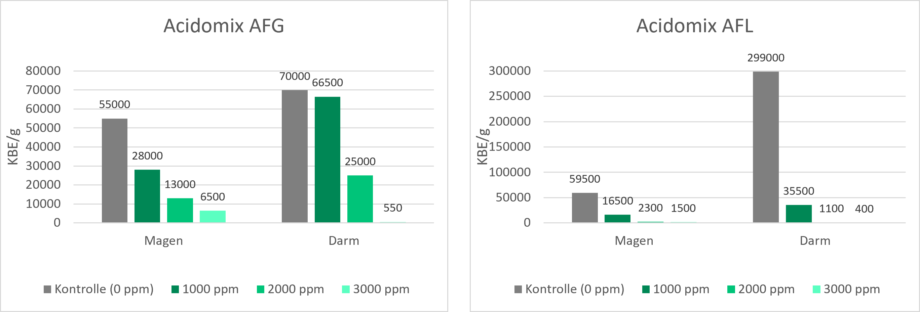
Da Salmonellen keine sauren Bedingungen mögen, ist das Ansäuern des Futters mit organischen Säuren eine wirksame Maßnahme. Zur Überprüfung wurde die Wirkung von Acidomix AFG und Acidomix AFL gegen Salmonellen im Versuch getestet. Dafür wurden 105 KBE/g Salmonella enterica ser. Typhimurium Futterproben zugesetzt, die 1000 ppm, 2000 ppm oder 3000 ppm Acidomix AFG oder AFL enthielten. Die Bedingungen im Magen und im Darm wurden in vitro simuliert, indem der pH-Wert mit HCl und NaHCO3 wie folgt eingestellt wurde:
Magen 2.8
Darm 6.8-7.0
Nach der jeweiligen Inkubation wurden die Mikroorganismen aus dem Futter isoliert und auf einem geeigneten Medium zur KBE-Zählung ausgestrichen. Die Ergebnisse sind in den Abbildungen 3 und 4 dargestellt.
Phytomoleküle können Schweine gegen Salmonellen unterstützen
Auch Pflanzenstoffe oder Phytomoleküle können bei Schweinen gegen Salmonellen eingesetzt werden. Einige Beispiele für verwendbare Phytomoleküle sind Piperin, Allicin, Eugenol und Carvacrol. Eugenol erhöht beispielsweise die Permeabilität der Salmonellenzellmembran, zerstört die Zytoplasmamembran und hemmt die Produktion bakterieller Virulenzfaktoren (Keita et al., 2022; Mak et al., 2019). Thymol und Carvacrol interagieren über H-Brücken mit der Zellmembran, was ebenfalls zu einer höheren Permeabilität führt.
Ein bereits veröffentlichter In-vitro -Versuch mit unserem Produkt Ventar D zeigte hervorragende Wirkungen gegen Salmonellen bei gleichzeitiger Schonung der nützlichen Darmflora. Auch ein weiterer Versuch konnte die Anfälligkeit von Salmonellen gegenüber Ventar D demonstrieren. Ventar D bekämpfte in diesem Versuch die eingesetzten Salmonellen durch Unterdrückung ihrer Beweglichkeit und, bei höheren Konzentrationen von Ventar D, durch Inaktivierung der Zellen (siehe Abbildungen 5 + 6):

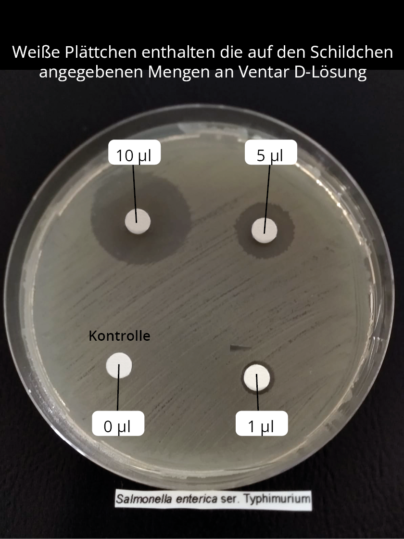
Neben der direkten Salmonellen-reduzierenden Wirkung verbessern ätherische Öle / sekundäre Pflanzenstoffe / Phytomoleküle die Aktivität von Verdauungsenzymen und die Verdauung, was zu einer erhöhten Nährstoffaufnahme und einer besseren Futterverwertung führt (Windisch et al., 2008).
3. Was kann der Landwirt in Bezug auf die Salmonellenbelastung im Schlachthof tun?
Generell ist das Schlachthofpersonal für ein angemessenes Hygienemanagement verantwortlich, um eine Kontamination von Schlachtkörpern und Fleisch zu verhindern. Aber auch der Landwirt kann seinen Beitrag dazu leisten, das Kontaminationsrisiko im Schlachthof so gering wie möglich zu halten. Eine Studie von Vieira-Pinto (2006) ergab, dass ein Salmonellen-positives Schwein mehrere andere Schlachtkörper kontaminieren kann.
Laut einer Studie von Hurd et al. (2002) kann es schnell zu einer Infektion und damit zur “Kontamination“ anderer Schweine kommen. Kreuzkontaminationen beim Transport zum Schlachthof und in den Ställen sind dementsprechend durchaus ein Thema, wenn die Schweine mit Tieren aus anderen Betrieben zusammenkommen. Der Stress, dem die Schweine ausgesetzt sind, beeinflusst physiologische und biochemische Prozesse. Das Mikrobiom und die Immunität der Tiere werden beeinträchtigt und es kommt zu einer höheren Salmonellenausscheidung beim Transport und in den Warteställen. Daher sollten die Tiere beim Be- und Entladen sowie beim Transport möglichst keinem Stress ausgesetzt werden. Der Anhänger für den Transport birgt ein weiteres Infektionsrisiko, wenn er nicht vorher gereinigt und desinfiziert wurde. Für den Transport sollten daher zuverlässige Personen ausgewählt werden, die die Tiere gut behandeln und ihre Transportfahrzeuge sauber halten.
Schweinehalter müssen Salmonellen in Schach halten – Phytomoleküle können dabei helfen
Zumindest in der EU haben Schweineproduzenten die große Verantwortung, die Salmonellenbelastung in ihren Beständen niedrig zu halten, andernfalls kommen finanzielle Verluste auf sie zu. Sie sind nicht nur für ihren Betrieb verantwortlich, auch die Schlachthöfe zählen auf sie. Neben einem standardmäßigen strengen Hygienemanagement und Impfungen können Landwirte auf von der Industrie bereitgestellte Produkte zur Desinfektion von Futtermitteln zurückgreifen, ihre Tiere aber auch direkt mit Phytomolekülen unterstützen, die gegen Krankheitserreger wirken und die Darmgesundheit unterstützen.
All diese Maßnahmen zusammen sollten helfen, die große Herausforderung „Salmonellen“ zu meistern – um Menschen zu schützen und wirtschaftliche Verluste zu verhindern.
Literatur:
Alborali, Giovanni Loris, Jessica Ruggeri, Michele Pesciaroli, Nicola Martinelli, Barbara Chirullo, Serena Ammendola, Andrea Battistoni, Maria Cristina Ossiprandi, Attilio Corradi, and Paolo Pasquali. “Prime-Boost Vaccination with Attenuated Salmonella Typhimurium Δznuabc and Inactivated Salmonella Choleraesuis Is Protective against Salmonella Choleraesuis Challenge Infection in Piglets.” BMC Veterinary Research 13, no. 1 (2017): 284. https://doi.org/10.1186/s12917-017-1202-5.
Balaji, R, K J Wright, C M Hill, S S Dritz, E L Knoppel, and J E Minton. “Acute Phase Responses of Pigs Challenged Orally with Salmonella Typhimurium.” Journal of Animal Science 78, no. 7 (2000): 1885. https://doi.org/10.2527/2000.7871885x.
Bearson, Bradley L, Shawn M. Bearson, Brian W Brunelle, Darrell O Bayles, In Soo Lee, and Jalusa D Kich. “Salmonella Diva Vaccine Reduces Disease, Colonization, and Shedding Due to Virulent S. Typhimurium Infection in Swine.” Journal of Medical Microbiology 66, no. 5 (2017): 651–61. https://doi.org/10.1099/jmm.0.000482.
Brenner Michael, G, M Cardoso, and S Schwarz. “Molecular Analysis of Salmonella Enterica Subsp. Enterica Serovar Agona Isolated from Slaughter Pigs.” Veterinary Microbiology 112, no. 1 (2006): 43–52. https://doi.org/10.1016/j.vetmic.2005.10.011.
Chen, P.-L., C.-M. Chang, C.-J. Wu, N.-Y. Ko, N.-Y. Lee, H.-C. Lee, H.-I. Shih, C.-C. Lee, R.-R. Wang, and W.-C. Ko. “Extraintestinal Focal Infections in Adults with Non-typhoid Salmonella Bacteraemia: Predisposing Factors and Clinical Outcome.” Journal of Internal Medicine 261, no. 1 (2007): 91–100. https://doi.org/10.1111/j.1365-2796.2006.01748.x.
Chiu, Cheng-Hsun, Lin-Hui Su, and Chishih Chu. “Salmonella EntericaSerotype Choleraesuis: Epidemiology, Pathogenesis, Clinical Disease, and Treatment.” Clinical Microbiology Reviews 17, no. 2 (2004): 311–22. https://doi.org/10.1128/cmr.17.2.311-322.2004.
De Ridder, L., D. Maes, J. Dewulf, F. Pasmans, F. Boyen, F. Haesebrouck, E. Méroc, P. Butaye, and Y. Van der Stede. “Evaluation of Three Intervention Strategies to Reduce the Transmission of Salmonella Typhimurium in Pigs.” The Veterinary Journal 197, no. 3 (2013): 613–18. https://doi.org/10.1016/j.tvjl.2013.03.026.
Deane, Annette, Declan Murphy, Finola C. Leonard, William Byrne, Tracey Clegg, Gillian Madigan, Margaret Griffin, John Egan, and Deirdre M. Prendergast. “Prevalence of Salmonella spp. in Slaughter Pigs and Carcasses in Irish Abattoirs and Their Antimicrobial Resistance.” Irish Veterinary Journal 75, no. 1 (2022). https://doi.org/10.1186/s13620-022-00211-y.
Edel, W., M. Schothorst, P. A. Guinée, and E. H. Kampelmacher. “Effect of Feeding Pellets on the Prevention and Sanitation of Salmonella Infections in Fattening Pigs1.” Zentralblatt für Veterinärmedizin Reihe B 17, no. 7 (2010): 730–38. https://doi.org/10.1111/j.1439-0450.1970.tb01571.x.
EFSA. “Salmonella.” European Food Safety Authority. Accessed August 7, 2023. https://www.efsa.europa.eu/en/topics/topic/salmonella.
Elbediwi, Mohammed, Daiwei Shi, Silpak Biswas, Xuebin Xu, and Min Yue. “Changing Patterns of Salmonella Enterica Serovar Rissen from Humans, Food Animals, and Animal-Derived Foods in China, 1995–2019.” Frontiers in Microbiology 12 (2021). https://doi.org/10.3389/fmicb.2021.702909.
Elnekave, Ehud, Samuel Hong, Alison E Mather, Dave Boxrud, Angela J Taylor, Victoria Lappi, Timothy J Johnson, et al. “Salmonella Enterica Serotype 4,[5],12:I:- In Swine in the United States Midwest: An Emerging Multidrug-Resistant Clade.” Clinical Infectious Diseases 66, no. 6 (2018): 877–85. https://doi.org/10.1093/cid/cix909.
FCC Consortium. “Final Report – Food Safety.” European Commission, 2010. https://food.ec.europa.eu/system/files/2016-10/biosafety_food-borne-disease_salmonella_fattening-pigs_slaughthouse-analysis-costs.pdf.
Ferrari, Rafaela G., Denes K. Rosario, Adelino Cunha-Neto, Sérgio B. Mano, Eduardo E. Figueiredo, and Carlos A. Conte-Junior. “Worldwide Epidemiology of Salmonella serovars in Animal-Based Foods: A Meta-Analysis.” Applied and Environmental Microbiology 85, no. 14 (2019). https://doi.org/10.1128/aem.00591-19.
“FSIS Guideline to Control Salmonella in Swine Slaughter and Pork Processing Establishments.” FSIS Guideline to Control Salmonella in Swine Slaughter and Pork Processing Establishments | Food Safety and Inspection Service. Accessed August 14, 2023. https://www.fsis.usda.gov/guidelines/2023-0003.
Gal-Mor, Ohad, Erin C. Boyle, and Guntram A. Grassl. “Same Species, Different Diseases: How and Why Typhoidal and Non-Typhoidal Salmonella Enterica Serovars Differ.” Frontiers in Microbiology 5 (2014). https://doi.org/10.3389/fmicb.2014.00391.
González-Santamarina, Belén, Silvia García-Soto, Helmut Hotzel, Diana Meemken, Reinhard Fries, and Herbert Tomaso. “Salmonella Derby: A Comparative Genomic Analysis of Strains from Germany.” Frontiers in Microbiology 12 (2021). https://doi.org/10.3389/fmicb.2021.591929.
Government of South Australia. Typhoid and paratyphoid – including symptoms, treatment, and prevention, April 3, 2022. https://www.sahealth.sa.gov.au/wps/wcm/connect/public+content/sa+health+internet/conditions/infectious+diseases
/typhoid+and+paratyphoid/typhoid+and+paratyphoid+-+including+symptoms+treatment+and+prevention.
Hauser, Elisabeth, Erhard Tietze, Reiner Helmuth, Ernst Junker, Kathrin Blank, Rita Prager, Wolfgang Rabsch, Bernd Appel, Angelika Fruth, and Burkhard Malorny. “Pork Contaminated with Salmonella Enterica Serovar 4,[5],12:I:−, an Emerging Health Risk for Humans.” Applied and Environmental Microbiology 76, no. 14 (2010): 4601–10. https://doi.org/10.1128/aem.02991-09.
Health and Wellbeing; address=11 Hindmarsh Square, Adelaide scheme=AGLSTERMS.AglsAgent; corporateName=Department for. “Sa Health.” Typhoid and paratyphoid – including symptoms, treatment, and prevention, April 3, 2022. https://www.sahealth.sa.gov.au/wps/wcm/connect/public+content/sa+health+internet/conditions/infectious+diseases
/typhoid+and+paratyphoid/typhoid+and+paratyphoid+-+including+symptoms+treatment+and+prevention.
Hedemann, M. S., L. L. Mikkelsen, P. J. Naughton, and B. B. Jensen. “Effect of Feed Particle Size and Feed Processing on Morphological Characteristics in the Small and Large Intestine of Pigs and on Adhesion of Salmonella Enterica Serovar Typhimurium DT12 in the Ileum in Vitro1.” Journal of Animal Science 83, no. 7 (2005): 1554–62. https://doi.org/10.2527/2005.8371554x.
Hendriksen, Susan W.M., Karin Orsel, Jaap A. Wagenaar, Angelika Miko, and Engeline van Duijkeren. “Animal-to-Human Transmission ofSalmonellaTyphimurium DT104A Variant.” Emerging Infectious Diseases 10, no. 12 (2004): 2225–27. https://doi.org/10.3201/eid1012.040286.
Keita, Kadiatou, Charles Darkoh, and Florence Okafor. “Secondary Plant Metabolites as Potent Drug Candidates against Antimicrobial-Resistant Pathogens.” SN Applied Sciences 4, no. 8 (2022). https://doi.org/10.1007/s42452-022-05084-y.
Ministry of Agriculture, Fisheries and Food, and Scottish Executive Rural Affairs Department. “Salmonella on Pig Farms – Code of Practice for the Prevention and Control Of.” ReadkonG.com, 2000. https://www.readkong.com/page/code-of-practice-for-the-prevention-and-control-of-5160969.
Morrow, W.E. Morgan, and Julie Funk. Ms. Salmonella as a Foodborne Pathogen in Pork. North Carolina State University Animal Science, n.d.
Soumet, C., A. Kerouanton, A. Bridier, N. Rose, M. Denis, I. Attig, N. Haddache, and C. Fablet. Report, Salmonella excretion level in pig farms and impact of quaternary ammonium compounds based disinfectants on Escherichia coli antibiotic resistance § (2022).
Thisyakorn, Usa. “Typhoid and Paratyphoid Fever in 192 Hospitalized Children in Thailand.” Archives of Pediatrics & Adolescent Medicine 141, no. 8 (1987): 862. https://doi.org/10.1001/archpedi.1987.04460080048025.
Ung, Aymeric, Amrish Y. Baidjoe, Dieter Van Cauteren, Nizar Fawal, Laetitia Fabre, Caroline Guerrisi, Kostas Danis, et al. “Disentangling a Complex Nationwide Salmonella Dublin Outbreak Associated with Raw-Milk Cheese Consumption, France, 2015 to 2016.” Eurosurveillance 24, no. 3 (2019). https://doi.org/10.2807/1560-7917.es.2019.24.3.1700703.
Vieira-Pinto, M, R Tenreiro, and C Martins. “Unveiling Contamination Sources and Dissemination Routes of Salmonella Sp. in Pigs at a Portuguese Slaughterhouse through Macrorestriction Profiling by Pulsed-Field Gel Electrophoresis.” International Journal of Food Microbiology 110, no. 1 (2006): 77–84. https://doi.org/10.1016/j.ijfoodmicro.2006.01.046.
Waldron, P. “Keeping Cows and Humans Safe from Salmonella Dublin.” Cornell University College of Veterinary Medicine, December 25, 2018. https://www.vet.cornell.edu/news/20181218/keeping-cows-and-humans-safe-salmonella-dublin.
Wang, J.-H., Y.-C. Liu, M.-Y. Yen, J.-H. Wang, Y.-S. Chen, S.-R. Wann, and D.-L. Cheng. “Mycotic Aneurysm Due to Non-Typhi Salmonella: Report of 16 Cases.” Clinical Infectious Diseases 23, no. 4 (1996): 743–47. https://doi.org/10.1093/clinids/23.4.743.
WHO. “Salmonella (Non-Typhoidal).” World Health Organization, February 20, 2018. https://www.who.int/news-room/fact-sheets/detail/salmonella-(non-typhoidal).
Windisch, W., K. Schedle, C. Plitzner, and A. Kroismayr. “Use of Phytogenic Products as Feed Additives for Swine and Poultry1.” Journal of Animal Science 86, no. suppl_14 (2008). https://doi.org/10.2527/jas.2007-0459.
Windisch, W., K. Schedle, C. Plitzner, and A. Kroismayr. “Use of Phytogenic Products as Feed Additives for Swine and Poultry1.” Journal of Animal Science 86, no. suppl_14 (2008). https://doi.org/10.2527/jas.2007-0459.