Inge Heinzl, Marisabel Caballero, Ajay Bhoyar
Eliminacja martwiczego zapalenia jelit z hodowli zaczyna się od dobrego zrozumienia, co to jest, jak temu zapobiegać i jak złagodzić jego wpływ na produkcję drobiu.
Martwicze zapalenie jelit jest chorobą drobiu spowodowaną przerostem Clostridium perfringens typu A i w mniejszym stopniu typu C w jelicie cienkim. Toksyny wytwarzane przez C. perfringens uszkadzają również ścianę jelita. Na ogół występuje u brojlerów w wieku 2-6 tygodni. W postaciach subklinicznych charakteryzuje się zaburzeniami trawienia. Postacie kliniczne prowadzą do poważnych problemów i zwiększonej śmiertelności w stadach w bardzo krótkim czasie.
Martwicze zapalenie jelit jest przyczyną 6 miliardów dolarów strat w światowej produkcji drobiu, a ta dająca się kontrolować choroba, rośnie. Jednym z powodów jest dobrowolne lub wymagane prawem ograniczenie antybiotyków w produkcji zwierzęcej. Tendencja ta jest napędzana przez coraz częstsze występowanie oporności na środki przeciwdrobnoustrojowe, a także zapotrzebowanie konsumentów. Innym powodem jest redukcja jonoforów, które oprócz działania przeciwko kokcydiom, wykazują również skuteczność przeciwko Clostridia. Gdy stosuje się żywe szczepionki przeciw kokcydiozie, zastosowanie tych jonoforów nie jest możliwe i zwiększa się liczba Clostridia / martwiczego zapalenia jelit (Williams, 2005).
Chociaż jest to powszechny problem w przypadku wszystkich rodzajów drobiu, w szczególności w przypadku brojlerów, martwicowe zapalenie jelit i kokcydioza są najważniejszymi problemami zdrowotnymi.
Kliniczne i podkliniczne postacie ne
Postać kliniczna
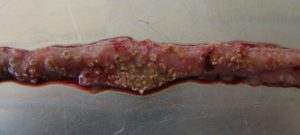
… Charakteryzuje się ostrą, ciemną biegunką powodującą mokrą ściółkę i nagle zwiększającą się śmiertelność stada nawet o 1% dziennie po pojawieniu się pierwszych objawów klinicznych (Ducatelle i Van Immerseel, 2010), czasami sumującą się do śmiertelności 50% (Van der Sluis, 2013). Ptaki mają potargane pióra, brak apetytu i są w letargu.
Sekcja zazwyczaj pokazuje balonowe jelito cienkie z szorstką powierzchnią błony śluzowej, zmianami i brązowawymi (błoniczymi) pseudobłonami. Podczas sekcji zwłok występuje dużo wodnistego brązowego, zabarwionego krwią płynu i nieprzyjemny zapach. Wątroba jest ciemna, opuchnięta i jędrna, a woreczek żółciowy rozdęty (Hofacre i wsp., 2018).
W przypadku nadostrego martwiczego zapalenia jelit ptaki mogą umrzeć bez żadnych objawów wstępnych.
Postać subkliniczna

Kiedy ptaki cierpią na postać subkliniczną, chroniczne uszkodzenie błony śluzowej jelit i zwiększoną ilość śluzu w jelicie cienkim, prowadzi to do upośledzenia trawienia i wchłaniania składników odżywczych, co prowadzi do słabej wydajności wzrostu.
Pogorszenie konwersji paszy i wynikająca z tego obniżona wydajność stają się zauważalne około 35 dnia życia. Ponieważ pasza stanowi około 65-75% kosztów produkcji brojlerów, słaba konwersja paszy zwiększa koszty produkcji i znacząco wpływa na rentowność. Często ze względu na brak wyraźnych objawów ta subkliniczna choroba pozostaje nieleczona i trwale wpływa na wydajność produkcji.
Patogeny
Za martwicę odpowiedzialne są Gram-dodatnie bakterie beztlenowe, specyficzne szczepy Clostridium perfringens typu A oraz w mniejszym stopniu typ C (Keyburn et al., 2008).
Clostridia występują głównie w glebie, w której rozkładają się substancje organiczne, w ściekach oraz w przewodzie pokarmowym zwierząt i ludzi. Bakterie te wytwarzają przetrwalniki, które są niezwykle odporne na wpływ środowiska (ciepło, napromieniowanie, eksykkacja) oraz niektóre środki dezynfekujące i mogą przetrwać kilka lat. W odpowiednich warunkach zarodniki C. perfringens mogą nawet rozmnażać się w paszy lub ściółce.
Clostridium perfringens to naturalny mieszkaniec jelita kur. U zdrowych ptaków, występuje w wielu różnych szczepów na 10 -10 4 2 CFU / g treści pokarmowej (McDevitt’a i wsp., 2006). Choroba zaczyna się, gdy C. perfringens namnaża się w jelicie cienkim, zwykle z powodu połączenia czynników, takich jak: duża ilość białka, niska odporność i brak równowagi we florze jelitowej. Następnie, ilość zwiększa się do 10 -10 7 9 CFU / g treści pokarmowej (Dahiya i wsp., 2005).
NetB, kluczowy czynnik zjadliwości dla NE
Aby zadomowić się w gospodarzu, Clostridium Spp. a inne patogeny zależą od czynników wirulencji (patrz infobox). Te czynniki zjadliwości obejmują na przykład „narzędzia” do przywiązywania się, unikania lub tłumienia układu odpornościowego gospodarza, „narzędzia” do pozyskiwania składników odżywczych i „narzędzia” do wchodzenia do komórek jelitowych. Przez lata zakładano, że toksyna α wytwarzana przez C. perfringens jest zaangażowana w rozwój choroby i kluczowy czynnik zjadliwości. W 2008 roku Keyburn i współpracownicy odkryli inny kluczowy czynnik zjadliwości, używając mutanta C. perfringens niezdolnego do wytwarzania toksyny α, ale nadal powodującego martwicze zapalenie jelit.
W ten sposób zidentyfikowano inną toksynę występującą tylko u kurczaków cierpiących na martwicze zapalenie jelit: C. perfringens toksyna podobna do martwiczego zapalenia jelit typu B (NetB). NetB to toksyna tworząca pory. Toksyny tworzące pory to egzotoksyny zwykle wytwarzane przez bakterie chorobotwórcze, ale mogą być również wytwarzane przez inne mikroorganizmy. Te toksyny niszczą integralność błon komórkowych ściany jelita. Wyciekająca zawartość komórek służy jako składniki odżywcze dla bakterii. Jeśli komórki odpornościowe zostaną zniszczone, może to częściowo wpłynąć na reakcję immunologiczną (Los i in., 2013).
Dodatkowo patogenne szczepy C. perfringens wytwarzają bakteriocyny – najważniejszą z nich jest Perfrin (Timbermont et al., 2014) – do zahamowania proliferacji nieszkodliwych Clostridium Spp. szczepów i zastąpienia normalnej flory jelitowej kurczaków (Riaz et al., 2017).
Przykłady czynników zjadliwości
- Adhezyny
Umożliwiają patogenowi przyleganie lub przyczepianie się w docelowym miejscu gospodarza, np. przez fimbrię. Pili umożliwiają wymianę RNA lub DNA między patogenami. - Czynniki inwazji
Ułatwiają penetrację i dystrybucję patogenów w tkance żywiciela (inwazja i rozprzestrzenianie się enzymów). Na przykład: hialuronidaza atakująca kwas hialuronowy tkanki łącznej lub wici, umożliwiająca czynny ruch patogenów. - Toksyny
Uszkadzają lub niszczą komórki gospodarza (np. Endotoksyny – lipopolisacharydy, egzotoksyny) - Strategie uników
Umożliwiają patogenowi poddanie się strategiom obronnym układu odpornościowego (np. czynniki antyfagocytozy zapewniają ochronę przed atakiem fagocytów, specyficzne przeciwciała są inaktywowane przez enzymy).
Kurczak o optymalnym zdrowiu jelit może być mniej podatny na NE. Dodatkowe czynniki predysponujące są niezbędne do wydzielenia składników odżywczych i dostosowania środowiska jelitowego do proliferacji tych patogenów, umożliwiając im wywoływanie chorób (Van Immerseel i in., 2008; Williams, 2005).
Czynniki predysponujące
Pasza: skład i wielkość cząstek
Nie należy lekceważyć roli paszy w rozwoju martwiczego zapalenia jelit. Tutaj do gry wchodzą substancje tworzące środowisko jelitowe sprzyjające C. perfringens.

Zanieczyszczenie mykotoksynami
Mikotoksyny szkodzą integralności jelit i stwarzają idealne warunki do namnażania się Clostridium perfringens .
Mikotoksyny nie mają bezpośredniego wpływu na proliferację C. perfringens, produkcję toksyn ani transkrypcję NetB. Jednak mykotoksyny zakłócają integralność zdrowotną jelit, tworząc sprzyjające środowisko dla patogenu. Na przykład:
- DON zapewnia dobre warunki do proliferacji perfringens poprzez przerwanie bariery jelitowej i uszkodzenie nabłonka. Prawdopodobnie wynikająca z tego przepuszczalność nabłonka i zmniejszone wchłanianie białek pokarmowych mogą prowadzić do większej ilości białek w jelicie cienkim. Białka te mogą służyć jako składniki odżywcze dla patogenu (Antonissen et al., 2014).
- DON i inne mykotoksyny zmniejszają liczbę bakterii wytwarzających kwas mlekowy, wskazując na zmianę równowagi mikrobiologicznej (Antonissen i in., 2016.).
Eimeria ssp.
Nienaruszony nabłonek jelitowy jest najlepszą obroną przed potencjalnymi patogenami, takimi jak C. perfringens. Tutaj pojawia się kokcydioza. Moore (2016) wykazał, że przez uszkodzenie nabłonka jelita, gatunki Eimeria dają C. perfringens dostęp do podstawowych domen nabłonka śluzówki jelit. Następnie następuje pierwsza faza procesu patologicznego i stamtąd C. perfringens atakuje blaszkę właściwą. Następuje uszkodzenie nabłonka (Olkowski i in., 2008). Białka osocza wyciekające do jelit i wytwarzany śluz są bogatymi źródłami składników odżywczych (Van Immerseel i in., 2004; Collier i in., 2008). Kolejnym skutkiem kokcydiozy jest zmiana równowagi mikrobiologicznej w jelitach poprzez zmniejszenie liczby np. Candidatus savagella, który aktywuje wrodzoną obronę immunologiczną.
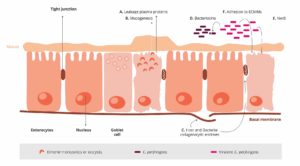
- Eimeria wywołuje wyciek białek osocza poprzez zabijanie komórek nabłonka
- Wzmacniają produkcję śluzu w jelicie
1 + 2 prowadzą do zwiększenia ilości dostępnych składników odżywczych i tworzą środowisko sprzyjające namnażaniu się C. perfringens
Nie tylko Eimeria Spp., Ale także inne patogeny (np. Salmonella Spp., Larwy Ascarid, wirusy) i czynniki, takie jak mykotoksyny uszkadzające błonę śluzową jelit, mogą utorować drogę do zakażenia C. perfringens. Czynniki predysponujące, takie jak mokra ściółka, której wilgoć jest niezbędna do zarodnikowania Eimeria Spp. oocysty należy również wziąć pod uwagę jako czynniki sprzyjające martwicowemu zapaleniu jelit (Williams, 2005).
Czynniki immunosupresyjne
Oprócz wyjaśnionej już paszy dla influencerów, mykotoksyn i kokcydiów, należy również wspomnieć o innych czynnikach predysponujących. Ogólnie rzecz biorąc, każdy czynnik wywołujący stres u zwierząt zaburza równowagę flory jelitowej. Wynikająca z tego supresja układu odpornościowego przyczynia się do ryzyka martwiczego zapalenia jelit (Tsiouris, 2016). Czynniki te obejmują:
Bakterie : Shivaramaiah i wsp. (2011) zbadali noworodkową infekcję Salmonella typhimurium jako czynnik predysponujący do NE. Wczesna infekcja powoduje znaczne uszkodzenie jelita (Porter i wsp., 21) Dodatkowo Hassan i wsp. (1994) wykazali, że prowokacja Salmonella typhimurium negatywnie wpłynęła na rozwój limfocytów, co może również sprzyjać kolonizacji Clostridium perfringens.
Wirusy : Wiadomo, że zakaźna choroba torebek nasiennych zwiększa nasilenie infekcji salmonellą, gronkowcami, ale także clostridiami. Inne choroby wirusowe wywołujące Clostridię to Gumboro i choroba Marka.
Stres : Przewód pokarmowy jest szczególnie wrażliwy na wszelkiego rodzaju stres. Stres ten może być spowodowany np. zbyt wysokimi temperaturami, dużą gęstością hodowli, nagłą zmianą paszy.

Leczenie
W ostrych przypadkach rolnik powinien skonsultować się z lekarzem weterynarii i leczyć swoje ptaki.
Należy wspomnieć, że ponieważ obróbka odbywa się za pomocą paszy lub wody, mogą być leczone tylko ptaki, które nadal spożywają wodę lub paszę.
Antybiotyki
W leczeniu ostrej NE powszechnie stosuje się antybiotyki ukierunkowane na bakterie Gram-dodatnie. Wyboru antybiotyku dokonuje lekarz weterynarii, biorąc pod uwagę sposób działania oraz obecność genów oporności w gospodarstwie / stadzie.
Nie zaleca się profilaktycznego stosowania antybiotyków, a wiele krajów już zakazało ich używania w celu zmniejszenia oporności na środki przeciwdrobnoustrojowe (AMR).
Oporność na środki przeciwdrobnoustrojowe (AMR)
Niektóre bakterie są mniej wrażliwe na niektóre antybiotyki z powodu mutacji genetycznych. Są w stanie zrobić:
-
- stymulują produkcję enzymów, które rozkładają lub modyfikują antybiotyki i inaktywują je (1)
- eliminują wejścia dla antybiotyków lub promują rozwój pomp, które dymisjonują antybiotyk przed jego działaniem (2)
- zmienić lub wyeliminować cząsteczki, z którymi antybiotyk miałby się wiązać (cele dla antybiotyków).
Oznacza to, że gdy stosuje się odpowiednie antybiotyki, bakterie odporne na te antybiotyki przeżywają. Dzięki wyeliminowaniu ich konkurentów są w stanie lepiej się rozmnażać.
Dodatkowo oporność ta może być przenoszona za pomocą „genów odporności”
- do komórek potomnych
- poprzez ich spożycie z martwych bakterii (3)
- poprzez poziomy transfer genów (4)
- przez wirusy (5)
Każde zastosowanie antybiotyków sprzyja rozwojowi oporności (Robert Koch Institute, 2019). Krótkotrwałe stosowanie, lepsza bioasekuracja lub aplikacja w małych dawkach dają bakteriom większe szanse na adaptację.
Bakteriofagi
Eksperymentalne stosowanie terapii fagowych okazało się skuteczne w zmniejszaniu progresji choroby i objawów martwiczego zapalenia jelit (Miller i wsp., 2010). Poprzez doustne podanie koktajlu bakteriofagów Miller i współpracownicy mogli zmniejszyć śmiertelność o 92% u brojlerów prowokowanych C. perfringens w porównaniu z brojlerami poza kontrolą.
Mechanizm działania: endolizyny, wysoko rozwinięte enzymy wytwarzane przez bakteriofagi, są zdolne do trawienia ściany komórkowej bakterii w celu uwolnienia potomstwa faga (Fischetti, 2010). Jednak fagi nadal nie są zatwierdzane przez EFSA.
Zapobieganie
Zapobieganie chorobie jest zawsze lepsze – i bardziej opłacalne – niż jej leczenie.
Jak więc należy to zrobić?
Zapobieganie warunkom sprzyjającym proliferacji Clostridium perfringens i wzmacnianie odpowiedzi immunologicznej gospodarza zmniejsza prawdopodobieństwo wystąpienia choroby.
Oprócz wyeliminowania czynników predysponujących, głównymi celami są:
- Równowaga flory jelitowej
- Optymalizacja funkcji i integralności jelit
- Utrzymanie odporności
Bezpieczeństwo biologiczne
Istnieją dowody na to, że większość szczepów Clostridium wyizolowanych od ptaków cierpiących na martwicze zapalenie jelit może wywołać chorobę eksperymentalnie, podczas gdy szczepy izolowane od zdrowych ptaków nie mogą. Potwierdza to, że tylko określone szczepy są problematyczne (Ducatelle i Van Immerseel, 2010).
Dlatego niezwykle ważne jest, aby unikać wprowadzania tych patogennych szczepów do gospodarstwa.
- Surowe środki bezpieczeństwa biologicznego!
- Oddzielne ubrania, buty i urządzenia do mycia / dezynfekcji rąk w każdym kurniku
- Ponad 14 dni przestoju między stadami
Specyficzne środki przeciwko kokcydiozie
- Szczepionka
Według parazytologów u kurczaków występuje od 7 do 9 gatunków Eimeria, które nie zapewniają wzajemnej ochrony. Skuteczna szczepionka musi zawierać sporulowane oocysty najbardziej krytycznych patogennych gatunków Eimeria ( E. acervulina, E. maxima, E. tenella, E. necatrix i E. brunetti ). Im więcej gatunków zawartych w szczepionce, tym lepiej. Jednak jeśli nie zostaną zastosowane we właściwy sposób, szczepionki mogą być nieskuteczne lub powodować reakcje u ptaków, które mogą prowadzić do NE (Mitchell, 2017).
- Środki przeciw kokcydiozie
Aby uniknąć rozwoju oporności, ważne jest naprzemienne stosowanie chemikaliów (związków syntetycznych) i jonoforów (antybiotyków polieterowych) o różnych sposobach działania.
Jonofory mają specyficzny sposób działania i zabijają oocysty, zanim zdążą zainfekować ptaki. Będąc bardzo małymi, cząsteczki jonoforu mogą być pobierane i dyfundowane do zewnętrznej błony sporozoitu. Tam zmniejsza gradient stężeń prowadząc do gromadzenia się wody w sporozoicie powodując jego pękanie.
Dieta
Minimalizacja polisacharydów nieskrobiowych (NSP) w zbożach
Aby zapobiec „żerowaniu” Clostridium perfringens, należy unikać lub przynajmniej minimalizować wysoką zawartość rozpuszczalnych w wodzie, ale niestrawnych NSP, takich jak pszenica, produkty uboczne pszenicy i jęczmień. Dodatkowo w składzie paszy powinny być zawarte ksylanazy, aby zmniejszyć szkodliwe skutki NSP i poprawić wykorzystanie energii paszy. Zamiast tych zbóż do diety można włączyć kukurydzę. Ze względu na wysoką zawartość energii i wysoką dostępność składników pokarmowych uznawana jest za doskonały składnik diet brojlerów.
Formułowanie diet / diet niskobiałkowych z wysoce przyswajalnymi aminokwasami
Karmienie dietą niskobiałkową uzupełnioną krystalicznymi aminokwasami może być korzystne dla zmniejszenia ryzyka martwiczego zapalenia jelit (Dahiya i in., 2007). Aby poprawić strawność białka, a tym samym zmniejszyć proliferację C. perfringens, do paszy można dodać proteazy.
Unikanie / minimalizowanie tłuszczów zwierzęcych w diecie
Tłuszcze zwierzęce mają tendencję do zwiększania liczby Clostridium perfringens ; w związku z tym należy je zastąpić źródłami tłuszczu roślinnego.
Forma paszy
Pod względem formy paszy Engberg i wsp. (2002) stwierdzili, że ptaki karmione granulatem wykazywały zmniejszoną liczbę Clostridium perfringens w jelicie ślepym i odbytnicy niż ptaki karmione papką. Branton i współpracownicy (1987) podali niższą śmiertelność przy podawaniu paszy mielonej na walcach (grubo zmielonej) niż w przypadku paszy mielonej w młynie.
Dodatki
Dodatki można stosować albo w celu zapobiegania namnażaniu się Clostridium perfringens, albo w celu zmiany warunków środowiskowych w taki sposób, aby zapobiec proliferacji C. perfringens.
Probiotyki
Te żywe suplementy mikrobiologiczne mogą pomóc w ustanowieniu, utrzymaniu lub przywróceniu mikroflory jelitowej.
Sposób działania:
- konkurują z bakteriami chorobotwórczymi o substraty i miejsca przyczepu
- wytwarzają substancje przeciwdrobnoustrojowe hamujące rozwój bakterii chorobotwórczych (Gillor et al., 2008)
- wiąże i neutralizuje enterotoksyny (Mathipa i Thantsha, 2017)
- promować funkcje odpornościowe gospodarza (Yang i in., 2012)
Prebiotyki
- Te składniki pasz służą jako substraty do promowania korzystnych bakterii w jelicie.
Sposób działania:
- D-mannoza lub fruktoza, skrobie nieulegające trawieniu przez ptaki, wybiórczo stymulują wzrost i aktywność „dobrej” flory jelitowej
- Fruktooligosacharydy zmniejszają ilość perfringens i E. coli w jelitach i zwiększają różnorodność Lactobacillus Spp. (Kim i in., 2011)
- Donoszono, że galaktooligosacharydy, w połączeniu z probiotykiem na bazie lactis, wybiórczo promują proliferację Bifidobacterium Spp. (Jung i in., 2008).
Kwasy organiczne
Kwasy organiczne są często stosowane w dietach zwierząt w celu poprawy zdrowia jelit.
Sposób działania:
- obniżone pH sprzyja korzystnym bakteriom
- kwas kaprylowy tłumi perfringens, ale także Salmonella Spp. poprzez hamowanie ich wykorzystania glukozy (Skrivanova et al., 2006)
- kwas laurynowy, cytrynowy, oleinowy i linolowy oraz średniołańcuchowe kwasy tłuszczowe (C8-C14) hamują wzrost perfringens
Fitomolekuły
Fitomolekuły, znane również jako drugorzędne związki roślinne, są od wieków stosowane przeciwko patogenom. Ogólnie wiadomo, że dwie podgrupy tych substancji są skuteczne przeciwko Clostridium perfringens :
Garbniki
- Wiele badań wykazało skuteczność tanin przeciwko różnym patogenom, takim jak robaki pasożytnicze, Eimeria, wirusy i bakterie
- Wyciągi z kasztanowca i drzewa quebracho są skuteczne nie tylko przeciwko perfringens, ale także na jego toksyny (Elizando i in., 2010)
- Aktywność tanin przeciwko Eimeria (Cejas i in., 2011) i Salmonella Sp., Dwa czynniki predysponujące do NE.
Olejki eteryczne
- Ich hydrofobowość umożliwia im interakcję z lipidami błony perfringens.
- Mogą wnikać w błonę bakteryjną i zakłócać jej integralność.
- Zwiększa to przepuszczalność błony komórkowej dla jonów i innych małych cząsteczek, takich jak ATP, co prowadzi do zmniejszenia gradientu elektrochemicznego powyżej błony komórkowej i utraty równoważników energii komórki.
Oprócz bezpośredniego wpływu na Clostridium Spp., Wiele fitomolekuł poprawia zdrowie jelit i pomaga zapobiegać namnażaniu się Clostridium Spp. a zatem martwicze zapalenie jelit.
Substancje wiążące mikotoksyny / toksyny bakteryjne
Te segregatory mają dwa tryby działania:
- Wiążąc mikotoksyny, można zmniejszyć uszkodzenie nabłonka jelita lub nawet mu zapobiec, tak że nie powstają warunki do proliferacji Clostridium.
- Wiązanie toksyn wytwarzanych przez Clostridium perfringens może zmniejszyć występowanie lub nasilenie zmian:
Alfa-toksyna, fosfolipaza C, hydrolizuje fosfolipidy błonowe i uszkadza erytrocyty, leukocyty, miocyty i komórki śródbłonka oraz powoduje ich lipolizę (Songer, 1996). Prowadzi to do martwicy i uszkodzenia tkanki.
- Wiązanie toksyny NetB, kluczowego czynnika zjadliwości, może zmniejszyć nasilenie martwiczego zapalenia jelit.
Wniosek
Stale rosnąca tendencja do zmniejszania stosowania antybiotyków i jonoforów przyczynia się do zwiększonej częstości występowania martwiczego zapalenia jelit w produkcji drobiu.
Subkliniczna postać martwiczego zapalenia jelit na ogół pozostaje niezauważona, co skutkuje niską wydajnością paszy i jest główną przyczyną strat finansowych producentów drobiu.
Utrzymanie optymalnego zdrowia jelit jest kluczem do zapobiegania występowaniu martwiczego zapalenia jelit. W dobie wolnej od antybiotyków produkcji drobiu należy rozważyć alternatywne metody zwalczania tej chorobotwórczej bakterii, a także czynników predysponujących ją do zwalczania tej wyniszczającej choroby.

References
Annett, C.B., J. R. Viste, M. Chirino-Trejo, H. L. Classen, D. M. Middleton, and E. Simko. “Necrotic enteritis: effect of barley, wheat and corn diets on proliferation of Clostridium perfringens type A.” Avian Pathology 31 (2002): 599– 602. https://doi.org/10.1080/0307945021000024544
Antonissen G, F. Van Immerseel, F. Pasmans, R. Ducatelle, F. Haesebrouck, L. Timbermont, M. Verlinden, G.P.J. Janssens, V. Eeckhaut, M. Eeckhout, S. De Saeger, S. Hessenberger, A. Martel, and S. Croubels. “The mycotoxin deoxynivalenol predisposes for the development of Clostridium perfringens-Induced necrotic enteritis in broiler chickens. PLoS ONE 9 no. 9 (2014): e108775. https://doi.org/10.1371/journal.pone.0108775
Antonissen, G., V. Eeckhaut, K. Van Driessche, L. Onrust , F. Haesebrouck, R. Ducatelle, R.J. Moore, and F. Van Immerseel. “Microbial Shifts Associated With Necrotic enteritis.” Avian Pathol. 45 no. 3 (2016): 308-312. https://doi.org/10.1080/03079457.2016.1152625
Branton, S.L., F.N. Reece, and W.M. Hagler. “Influence of a wheat diet on mortality of broiler chickens associated with necrotic enteritis.” Poultry Sci. 66 (1987): 1326-1330. https://doi.org/10.3382/ps.0661326
Cejas, E., S. Pinto, F. Prosdócimo, M. Batalle, H. Barrios, G. Tellez, and M. De Franceschi. “Evaluation of quebracho red wood (Schinopsis lorentzii) polyphenols vegetable extract for the reduction of coccidiosis in broiler chicks.” International Journal of Poultry Science 10 no. 5 (2011): 344–349. https://doi.org/10.3923/ijps.2011.344.349
Collier, C.T., C.L. Hofacre, A.M. Payne, D.B. Anderson, P. Kaiser, R.I. Mackie, and H.R. Gaskins. “Coccidia-induced mucogenesis promotes the onset of necrotic enteritis by supporting Clostridium perfringens growth.” Veterinary Immunology and Immunopathology 122 (2008):104–115.
https://doi.org/10.1016/j.vetimm.2007.10.014
Dahiya, J.P., D. Hoehler, A.G. Van Kessel, and M.D. Drew. “Effect of different dietary methionine sources on intestinal microbial populations in broiler chickens.” Poultry Science 86 (2007):2358–2366
https://doi.org/10.3382/ps.2007-00133
Dahiya, J.P., D. Hoehler, D.C. Wilkie, A.G. van Kessel, and M.D. Drew. “Dietary glycine concentration affects intestinal Clostridium perfringens and Lactobacilli populations in broiler chickens.” Poultry Science 84 no.12 (2005):1875-85. https://doi.org/10.1093/ps/84.12.1875
Diaz Carrasco, J.M., L.M. Redondo, E.A. Redondo, J.E. Dominguez, A.P. Chacana, and M.E. Fernandez Miyakawa. “Use of plant extracts as an effective manner to control Clostridium perfringens induced necrotic enteritis in poultry.” BioMed Research International (2016): Article ID 3278359. https://dx.doi.org/10.1155/2016/3278359
Ducatelle, R. and F. van Immerseel. “Necrotic enteritis: emerging problem in broilers.” WATTAgNet.com – Poultry Health and Disease (April 9, 2010).
https://www.wattagnet.com/articles/5523-necrotic-enteritis-emerging-problem-in-broilers
Elizondo, A.M., E.C. Mercado, B.C. Rabinovitz, and M.E. Fernandez-Miyakawa. “Effect of tannins on the in vitro growth of Clostridium perfringens.” Veterinary Microbiology 145 no. 3-4 (2010): 308–314. https://doi.org/10.1016/j.vetmic.2010.04.003
Engberg, R.M., M.S. Hedemann, and B.B. Jensen. “The influence of grinding and pelleting of feed on the microbial composition and activity in the digestive tract of broiler chickens.” · British Poultry Science 43 no. 4 (2002):569-579. https://doi.org/10.1080/0007166022000004480
Fischetti, V.A. “Bacteriophage endolysins: A novel anti-infective to control Gram-positive pathogens.” J Med Microbiol. 300 no. 6 (2010): 357–362. https://doi.org/10.1016/j.ijmm.2010.04.002
Gillor, O., A. Etzion and M.A. Riley. “The dual role of bacteriocins as anti- and probiotics.” Appl Microbiol Biotechnol. 81 no. 4 (2008): 591–606. https://doi.org/10.1007/s00253-008-1726-5
Hassan, J. O., and R. Curtiss III. “Virulent Salmonella typhimurium induced lymphocyte depletion and immunosuppression in chickens.” Infect. Immun. 62 (1994):2027–2036 https://doi.org/10.1128/IAI.62.5.2027-2036.1994
Hofacre, C.L., J.A. Smith, and G.F. Mathis. “Invited Review. An optimist’s view on limiting necrotic enteritis and maintaining broiler gut health and performance in today’s marketing, food safety, and regulatory climate.” Poultry Science 97 (2018):1929–1933. https://dx.doi.org/10.3382/ps/pey082
Jung, S.J., R. Houde, B. Baurhoo, X. Zhao, and B. H. Lee. “Effects of galacto-oligosaccharides and a bifidobacteria lactis-based probiotic strain on the growth performance and fecal microflora of broiler chickens.” Poultry Science 87 (2008):1694–1699. https://doi.org/10.3382/ps.2007-00489
Kaldhusdal and Skjerve. “Association between cereal contents in the diet and incidence of necrotic enteritis in broiler chickens in Norway.” Preventive Veterinary Medicine 28 (1996):1-16. https://doi.org/10.1016/0167-5877(96)01021-5
Keyburn, A. L., S. A. Sheedy, M. E. Ford, M. M. Williamson, M. M. Awad, J. I. Rood, and R. J. Moore. “Alpha-toxin of Clostridium perfringens is not an essential virulence factor in necrotic enteritis in chickens.” Infect. Immun. 74 (2006): 6496–6500. https://doi.org/10.1128/IAI.00806-06
Keyburn, A.L., J.D. Boyce, P. Vaz, T.L. Bannam, M.E. Ford, D. Parker, A. Di Rubbo, J.I. Rood, and R.J. Moore. “NetB, a new toxin that is associated with avian necrotic enteritis caused by Clostridium perfringens.” PLoS Pathog 4 no. 2, e26 (2008): 0001-0011. https://doi.org/10.1371/journal.ppat.0040026
Kim, G.-B., Y. M. Seo , C. H. Kim , and I. K. Paik. “Effect of dietary prebiotic supplementation on the performance, intestinal microflora, and immune response of broilers.” Poultry Science 90 (2011):75–82. https://doi.org/10.3382/ps.2010-00732
Knap, I., B. Lund, A. B. Kehlet, C. Hofacre, and G. Mathis. “Bacillus licheniformis prevents necrotic enteritis in broiler chickens.” Avian Diseases 54 no. 2 (2010):931-935. https://doi.org/10.1637/9106-101509-ResNote.1
Knarreborg, A., M.A. Simon, R.M. Engberg, B.B. Jensen, and G.W. Tannock. “Effects of Dietary Fat Source and Subtherapeutic Levels of Antibioticon the Bacterial Community in the Ileum of Broiler Chickensat Various Ages.” Applied and Environmental Microbiology 68 no. 12 (2002): 5918-5924. https://doi.org/0.1128/AEM.68.12.5918–5924.2002
Kocher, A. and M. Choct. “Improving broiler chicken performance. The efficacy of organic acids, prebiotics and enzymes in controlling necrotic enteritis.” Australian Government-Rural Industries Research and Development Corporation. Publ. no. 08/149 (2008).
https://www.agrifutures.com.au/wp-content/uploads/publications/08-149.pdf
Kondo, F. “In vitro lecithinase activity and sensitivity to 22 antimicrobial agents of Clostridium perfringens isolated from necrotic enteritis of broiler chickens.” Research in veterinary Science 45 (1988): 337-340. https://doi.org/10.1016/S0034-5288(18)30961-5
Kubena, L.F., J.A. Byrd, C.R. Young, and D.E. Corrier. “Effects of tannic acid on cecal volatile fatty acids and susceptibility to Salmonella typhimurium colonization in broiler chicks.” Poultry Science 80, no. 9 (2001): 1293–1298. https://doi.org/10.1093/ps/80.9.1293
Los, F.C.O., T.M. Randis, R.V. Aroian, and A.J. Ratner. “Role of pore-forming toxins in bacterial infectious diseases.” Microbiology and Molecular Biology Reviews 77 (2013): 173-207 https://doi.org/10.1128/MMBR.00052-12
M’Sadeq S.A., Shubiao Wu, Robert A. Swick, Mingan Choct. “Towards the control of necrotic enteritis in broiler chickens with in-feed antibiotics phasing-out worldwide.” Animal Nutrition 1 (2015): 1-11. https://dx.doi.org/10.1016/j.aninu.2015.02.004
Mathipa, M.G. and M.S. Thantsha. “Probiotic engineering: towards development of robust probiotic strains with enhanced functional properties and for targeted control of enteric pathogens.” Gut Pathog. 9 no. 28 (2017). https://doi.org/10.1186/s13099-017-0178-9
McDevitt, R.M., J.D. Brooker, T. Acamovic, and N.H.C. Sparks. “Necrotic enteritis, a continuing challenge for the poultry industry.” World’s Poultry Science Journal 62; World’s Poultry Science Association (June 2006). https://doi.org/10.1079/WPS200593
Miller, R.W., J. Skinner, A. Sulakvelidze, G.F. Mathis, and C.L. Hofacre. “Bacteriophage therapy for control of necrotic enteritis of broiler chickens experimentally infected with Clostridium perfringens.” Avian Diseases 54 no. 1 (2010): 33-40. https://doi.org/10.1637/8953-060509-Reg.1
Mitsch, P., K. Zitterl-Eglseer, B. Köhler, C. Gabler, R. Losa, and I. Zimpernik. “The Effect of Two Different Blends of Essential Oil Components on the Proliferation of Clostridium perfringens in the Intestines of Broiler Chickens.” Poultry Science 83 (2004):669–675. https://doi.org/10.1093/ps/83.4.669
Mitchell, A. “Choosing the right coccidiosis vaccine for layer and breeder chickens.” The Poultry Site March 21 (2017). https://thepoultrysite.com/articles/choosing-the-right-coccidiosis-vaccine-for-layer-and-breeder-chickens
Olkowski, A.A., C. Wojnarowicz, M. Chirino-Trejo, B. Laarveld, and G. Sawicki. “Sub-clinical necrotic enteritis in broiler chickens: Novel etiological consideration based on ultra-structural and molecular changes in the intestinal tissue.” Veterinary Science 85 (2008): 543–553. https://doi.org/10.1016/j.rvsc.2008.02.007
Pan, D. and Z. Yu. “Intestinal microbiome of poultry and its interaction with host and diet.” Gut Microbes 5 no. 1 (2014): 108–119. https://dx.doi.org/10.4161/gmic.26945
Porter, R., Jr. “Bacterial enteritides of poultry.” Poult. Sci. 77 (1998):1159–1165 https://doi.org/10.1093/ps/77.8.1159
Robert Koch Institut. “Grundwissen Antibiotikaresistenz“. https://www.rki.de/DE/Content/Infekt/Antibiotikaresistenz/Grundwissen/Grundwissen_inhalt.html#:~:text=Wenn%20ein%20neues%20Antibiotikum%20auf,%C3%BCberleben%20und%20vermehren%20sich%20weiter.
Rougière, N. and B. Carré. “Comparison of gastrointestinal transit times between chickens from D + and D- genetic lines selected for divergent digestion efficiency.” Animal 4 no. 11 (2010): 1861-1872. https://doi.org/10.1017/S1751731110001266
Santos, F.B.O., B.W. Sheldon, A.A. Santos Jr., and P.R. Ferket. ”Influence of housing system, grain type, and particle size on Salmonella colonization and shedding of broilers fed triticale or corn-soybean meal diets.” Poultry Science 87 (2008): 405-420. https://dx.doi.org/10.3382/ps.2006-00417
Schiavone, A. , K. Guo, S. Tassone, L .Gasco, E. Hernandez, R. Denti, and I. Zoccarato. “Effects of a Natural Extract of Chestnut Wood on Digestibility, Performance Traits, and Nitrogen Balance of Broiler Chicks.” Poult Sci. 87 no. 3 (2008): 521-527. https://doi.org/10.3382/ps.2007-00113
Shivaramaiah, S., R. E. Wolfenden, J. R. Barta, M. J. Morgan, A. D. Wolfenden, B. M. Hargis, and G. Téllez. „The role of an early Salmonella typhimurium infection as a predisposing factor for necrotic enteritis in a laboratory challenge model.” Avian Diseases 55 (2011): 319-323. https://doi.org/10.1637/9604-112910-ResNote.1
Singh, Y., V. Ravindran, T.J. Wester, A.L. Molan, and G. Ravindran. “ Influence of feeding coarse corn on performance, nutrient utilization, digestive tract measurements, carcass characteristics, and cecal microflora counts of broilers.” Poultry Science 93 (2014): 607–616. https://dx.doi.org/10.3382/ps.2013-03542
Skrivanova, E., M. Marounek, V. Benda, and P. Brezina. “Susceptibility of Escherichia coli, Salmonella sp. and Clostridium perfringens to organic acids and monolaurin.” Veterinarni Medicina 51 no. 3 (2006): 81–88. https://doi.org/10.17221/5524-VETMED
Songer, J.G. “Clostridial Enteric Diseases of Domestic Animals.” Clinical Microbiology Reviews 9 no. 2 (1996): 216-234. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC172891/pdf/090216.pdf
Stanley D., Wu S.-B., Rodgers N., Swick R.A., and Moore R.J. “Differential Responses of Cecal Microbiota to Fishmeal, Eimeria and Clostridium perfringens in a Necrotic Enteritis Challenge Model in Chickens.” PLoS ONE 9 no. 8 (2014): e104739. https://doi.org/10.1371/journal.pone.0104739
Tan, L., D. Rong, Y. Yang, and B. Zhang. “Effect of Oxidized Soybean Oils on Oxidative Status and Intestinal Barrier Function in Broiler Chickens.” Brazilian Journal of Poultry Science 18 no. 2 (2018): 333-342. http://dx.doi.org/10.1590/1806-9061-2017-0610
Tan, L., D. Rong, Y. Yang, and B. Zhang. “The Effect of Oxidized Fish Oils on Growth Performance, Oxidative Status, and Intestinal Barrier Function in Broiler Chickens.” J. Appl. Poult. Res. 28 (2019): 31-41. http://dx.doi.org/10.3382/japr/pfy013
ThePoultrySite. “Necrotic Enteritis. Disease Guide”. https://thepoultrysite.com/disease-guide/necrotic-enteritis
Timbermont L., A. Lanckriet, J. Dewulf, N. Nollet, K. Schwarzer, F. Haesebrouck, R. Ducatelle, and F. Van Immerseel. “Control of Clostridium perfringens-induced necrotic enteritis in broilers by target-released butyric acid, fatty acids and essential oils.” Avian Pathol. 39 no. 2 (2010): 117-21. https://doi.org/10.1080/03079451003610586
Tsiouris, V. “Poultry management: a useful tool for the control of necrotic enteritis in poultry.” Avian Pathol. 45 no. 3 (2016):323-325. https://doi.org/10.1080/03079457.2016.1154502
Van der Most, P.J., B. de Jong, H.K. Parmentier and S. Verhulst. “Trade-off between growth and immune function: a meta-analysis of selection experiments.” Functional Ecology 25 (2011): 74-80. https://doi.org/0.1111/j.1365-2435.2010.01800.x
Van der Sluis, W. “Clostridial enteritis is an often underestimated problem.” Worlds Poult. Sci. J. 16 (2000):42–43.
Van der Suis, W. “Necrotic enteritis kills birds and profits.” Poultry World Apr5 (2013). https://www.poultryworld.net/Health/Articles/2013/4/necrotic-enteritis-kills-birds-and-profits-1220877W/
Van Immerseel, F., J. De Buck, F. Pasmans, G. Huyghebaert, F. Haesebrouck, and R. Ducatelle. “Clostridium perfringens in poultry: an emerging threat of animal and public health.” Avian Pathology 33 (2004): 537-549. https://doi.org/10.1080/03079450400013162
Van Immerseel, F., J.I. Rood, R.J. Moore, and R.W. Titball. “Rethinking our understanding of the pathogenesis of necrotic enteritis in chickens.” Trends in Microbiology 17 no. 1 (2008):32-36. https://doi.org/10.1016/j.tim.2008.09.005
Wade, B., A. Keyburn. “The true cost of necrotic enteritis.” World Poultry 31 no. 7 (2015): 16–17. https://www.poultryworld.net/Meat/Articles/2015/10/The-true-cost-of-necrotic-enteritis-2699819W/
Wade, B., A.L. Keyburn, T. Seemann, J.I. Rood, and R.J. Moore. “Binding of Clostridium perfringens to collagen correlates with the ability to cause necrotic enteritis in chickens.” Veterinary Microbiology 180 no. 3–4 (2015): 299-303. https://doi.org/10.1016/j.vetmic.2015.09.019
Williams, R.B. “Intercurrent coccidiosis and necrotic enteritis of chickens: rational, integrated disease management by maintenance of gut integrity.” Avian Pathology 34 no. 3 (2005):159-180. https://doi.org/10.1080/03079450500112195
Yang , C.M., G.T. Cao, P.R. Ferket, T.T. Liu, L. Zhou, L. Zhang, Y.P. Xiao, and A. G. Chen. “ Effects of probiotic, Clostridium butyricum, on growth performance, immune function, and cecal microflora in broiler chickens.” Poultry Science 91 (2012): 2121–2129. https://dx.doi.org/10.3382/ps.2011-02131





