Eindämmung von Eimeria-Resistenzen in der Broiler-Produktion mit phytogenen Lösungen

Dr. Ajay Bhoyar, Global Technical Manager, EW Nutrition
In der modernen, intensiven Geflügelproduktion stellt die zunehmende Gefahr resistenter Eimeria-Stämme eine erhebliche Herausforderung für die Nachhaltigkeit der Broilerhaltung dar. Eimeria-Arten, die Resistenzen gegen herkömmliche Maßnahmen entwickeln können, sind zu einem weltweiten Problem geworden. Die Resistenz gegenüber herkömmlichen Medikamenten und die Sorge um Rückstände haben den Bedarf an natürlichen, sicheren und wirksamen Alternativen verstärkt.
Mehrere pflanzliche Verbindungen wie Saponine, Tannine, ätherische Öle, Flavonoide, Alkaloide und Lektine wurden intensiv auf ihre kokzidienhemmenden Eigenschaften untersucht. Unter ihnen haben sich insbesondere Saponine und Tannine bestimmter Pflanzen als wirksame Mittel im Kampf gegen diese widerstandsfähigen Protozoen erwiesen. Im Folgenden werden innovative Strategien vorgestellt, die das Potenzial dieser Stoffe – insbesondere von Saponinen und Tanninen – nutzen, um Verluste zu vermeiden, indem das Risiko resistenter Eimeria-Stämme in der Geflügelproduktion gemindert wird.
Was hat es mit resistenten Eimeria in der Broilerhaltung auf sich?
Die wissenschaftliche Abteilung der Weltgesundheitsorganisation (World Health Organization, 1965) definierte Resistenzen allgemein als die Fähigkeit eines Parasitenstamms, trotz Verabreichung und Aufnahme eines Medikaments in der empfohlenen Dosis zu überleben und/oder sich zu vermehren.
Die hohe Reproduktionsrate von Eimeria-Arten ermöglicht es ihnen, sich schnell weiterzuentwickeln und Resistenzen gegenüber den eingesetzten Medikamenten zu entwickeln. Darüber hinaus können resistente Eimeria-Stämme dank ihrer widerstandsfähigen Oozysten in der Umwelt überdauern, was zu einer erneuten Infektion von Tieren und einer weiteren Verbreitung führt.
Resistente Eimeria-Stämme stellen viele Herausforderungen in der modernen Geflügelhaltung dar und beeinträchtigen die Produktivität und wirtschaftliche Nachhaltigkeit erheblich. Eine der größten Schwierigkeiten ist die sinkende Wirksamkeit herkömmlicher Kokzidiostatika.
Unterschiedliche Arten von Eimeria-Resistenz
Es gibt verschiedene Ursachen dafür, warum Eimeria gegen bestimmte Wirkstoffe resistent sind.
Erworbene Resistenz entsteht durch eine vererbbare Abnahme der Empfindlichkeit bestimmter Stämme und Arten gegenüber Medikamenten im Laufe der Zeit. Diese kann partiell oder vollständig sein, abhängig vom Ausmaß des Empfindlichkeitsverlustes. Es besteht ein direkter Zusammenhang zwischen Wirkstoffkonzentration und Resistenzgrad. Ein Stamm, der durch eine bestimmte Dosis kontrolliert wird, kann bei einer niedrigeren Konzentration Widerstand zeigen.
Kreuzresistenz bedeutet, dass Resistenzen gegenüber verschiedenen Wirkstoffen mit ähnlichem Wirkmechanismus geteilt werden können (Abbas et al., 2011). Dies ist jedoch nicht immer der Fall (Chapman, 1997).
Mehrfachresistenz ist eine Resistenz gegenüber mehreren Wirkstoffen, auch wenn diese unterschiedliche Wirkmechanismen haben (Chapman, 1993).
Natürliche Stoffe können die Wirksamkeit Kokzidien-hemmender Maßnahmen wiederherstellen
Es wurde festgestellt, dass sich die Empfindlichkeit eines Parasiten gegenüber einem Wirkstoff wieder einstellen kann, wenn dieser für eine Zeit nicht mehr eingesetzt oder mit einem anderen Wirkstoff kombiniert wird (Chapman, 1997).
Pflanzenstoffe und naturidentische Verbindungen sind bekannt für ihre antimikrobielle und antiparasitäre Wirkung und stellen daher ein wertvolles Mittel gegen Eimeria dar (Cobaxin-Cardenas, 2018). Ihre Wirkmechanismen umfassen den Abbau der Zellwand, Schädigung des Zytoplasmas, Ionenverlust mit Verringerung der Protonenmotorkraft und die Induktion von oxidativem Stress, was die Invasion hemmt und die Entwicklung der Eimeria-Arten stört (Abbas et al., 2012; Nazzaro et al., 2013). Natürliche Kokzidien hemmende Mittel bieten einen neuen Ansatz zur Bekämpfung der Kokzidiose, insbesondere angesichts zunehmender Resistenzen in der kommerziellen Geflügelproduktion (Allen and Fetterer, 2002).
Saponine und Tannine: Die Abwehrkräfte der Natur gegen Eimeria
Phytogene Lösungen, speziell auf Basis von Saponinen und Tanninen, haben sich als vielversprechende Alternativen zur Minderung des Eimeria-Problems in der Geflügelproduktion herausgestellt. Mit ihrer Hilfe können Tierhalter die Widerstandskraft ihrer Bestände stärken, damit die Tiergesundheit fördern und die Nachhaltigkeit der Branche unterstützen.
Saponine sind Glykoside, die in vielen Pflanzen vorkommen und aufgrund ihrer Fähigkeit, in Wasser zu schäumen, charakteristische seifige Eigenschaften haben. Wenn es um Kokzidiose geht, können Saponine die Zellmembranen der Eimerien angreifen. Nach der Aufnahme mit dem Futter können Saponine die schützende Außenschicht der Eimeria schädigen, die Parasiten schwächen und sie für die Immunabwehr des Wirts angreifbar machen. Dieser Angriff mindert die Fähigkeit der Eimerien, sich an die Darmschleimhaut anzuheften und zu vermehren.
Tannine sind polyphenolische Verbindungen mit adstringierender Wirkung, die in Blättern, Rinde oder Früchten vorkommen. Entscheidend für den Erfolg von tanninhaltigen Futterzusätzen ist die Auswahl der passenden Tanninsorte in der richtigen Menge und zum passenden Zeitpunkt.
Gegen Eimerien wirken Tannine auf unterschiedliche Weise: In den Parasiten binden sie sich an Proteine stören enzymatische Aktivitäten und Stoffwechselprozesse. Diese Beeinträchtigung schwächt die Eimerien und verringert ihre Fähigkeit, die Darmschleimhaut zu schädigen. Darüber hinaus wirken Tannine entzündungshemmend und reduzieren die durch Eimeria verursachten Entzündungen. Als Antioxidantien schützen sie zudem die Darmzellen vor oxidativem Stress.
Werden Saponine und Tannine dem Broilerfutter zugegeben, schaffen sie ein ungünstiges Umfeld für Eimeria und hemmen deren Wachstum und Vermehrung im Wirt. Zusätzlich stärken sie die natürlichen Abwehrkräfte der Tiere und erhöhen deren Widerstandskraft gegenüber Infektionen. So können die Auswirkungen resistenter Eimeria-Stämme wirksam kontrolliert und eingedämmt werden, was die Gesundheit der Geflügelbestände und eine nachhaltige Geflügelproduktion fördert.
Was ist Pretect D?
Pretect D ist eine einzigartige, proprietäre Mischung aus Phytomolekülen, darunter Saponine und Tannine, die dabei hilft, Kokzidioseprobleme in der Geflügelhaltung in den Griff zu bekommen. Es kann allein aber auch in Kombination mit Kokzidiose-Impfstoffen, Ionophoren oder chemischen Mitteln im Rahmen eines Shuttle- oder Rotationsprogramms eingesetzt werden.
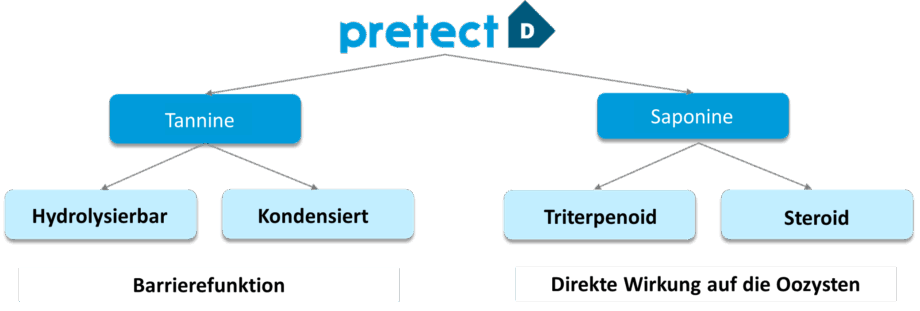
Abb.1. Die wichtigsten Bestandteile von Pretect D
Wie wirkt Pretect D
Pretect D wirkt auf mehreren Ebenen, um die Darmgesundheit in problematischen Zeiten zu unterstützen. Dank seiner antiparasitären, entzündungshemmenden, immunmodulierenden und antioxidativen Eigenschaften:
• reduziert es die Oozysten-Ausscheidung und dämmt die Verbreitung der Krankheit ein
• fördert es die Wiederherstellung der Schleimhautbarriere und verbessert die Darmstruktur
• schützt es das Darmepithel vor Schäden durch Entzündungen und oxidativem Stress.
Die positiven Effekte von Pretect D
Die Einbindung von Pretect D ins Kokzidiose-Programm verbessert die allgemeine Darmgesundheit und die Produktionsleistung der Broiler.
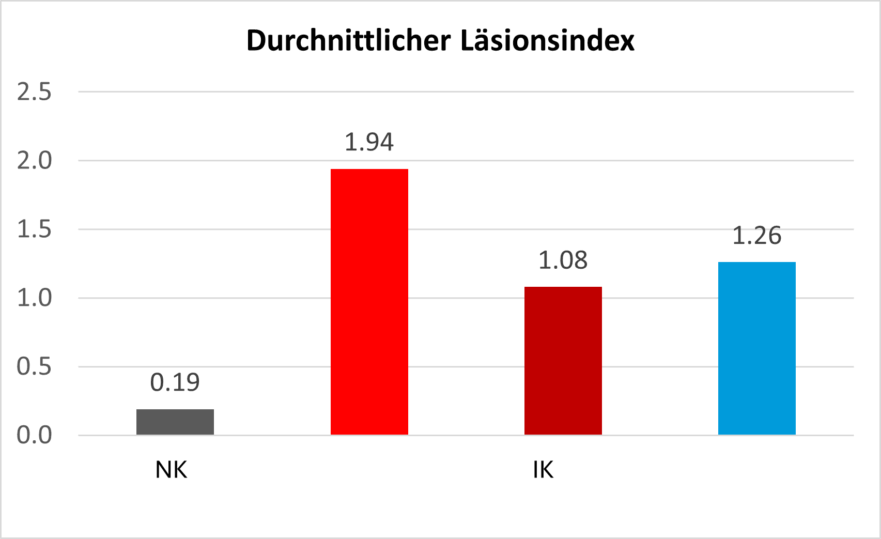
In einer Studie mit Cobb 500 Masthähnchen, die einer Eimeria-Mischinfektion ausgesetzt waren, zeigte sich, dass die Gruppe mit Pretect D (500 g/Tonne Futter über 35 Tage) weniger Kokzidien-Läsionen hatte als die infizierte Kontrollgruppe (IK).
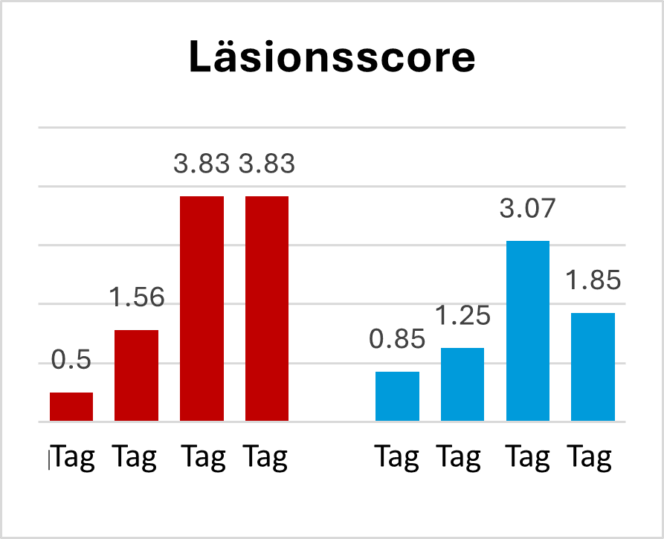
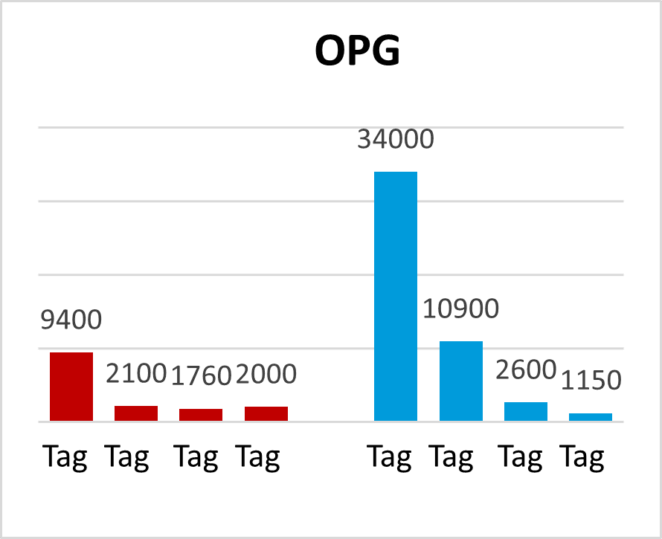
In einer weiteren Feldstudie wurde ein herkömmliches Kokzidiose-Programm (Starter und Mastfutter 1 mit Narasin + Nicarbazin, Mastfutter 2 mit Salinomycin und im End- und Ausmastfutter keine Kokzidiostatika) mit einem Programm verglichen, das Kokzidiostatika mit Pretect D kombinierte (Starter und Mastfutter 1 mit Narasin + Nicarbazin, Mastfutter 2 und Endmastfutter mit Pretect D). Die Zugabe von Pretect D senkte die Oozystenzahl und den Läsionsindex signifikant im Vergleich zur Kontrollgruppe (Abb. 3 a+b)
![]()
Abb 3a und 3b. Pretect D vermindert durch Kokzidiose verursachte Läsionen und die Anzahl an Oozysten pro Gramm Kot (OPG)
Daraus ergab sich eine insgesamt bessere Produktionsleistung der Broiler mit Pretect D (Abb. 4a-c):

Abb. 4 a-c. Verbesserte gesamte Produktionsleistung mit Pretect D
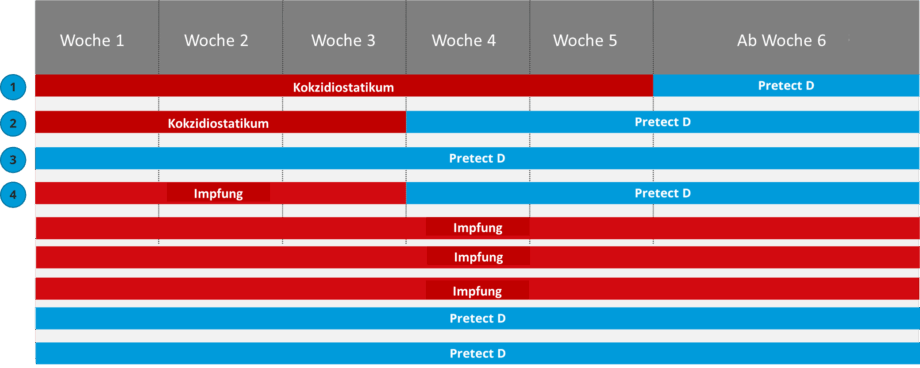
Pretect D: Anwendungsstrategien
Die Einbeziehung einer wirksamen phytogenen Kombination ins Kokzidiose-Kontroll-Programm kann helfen, das Resistenzproblem zu mindern. Eine solche natürliche Lösung kann eigenständig – vorzugsweise in weniger herausfordernden Monaten – oder in Kombination mit chemischen Mitteln (Shuttle-/Rotationsprogramme) oder einem Kokzidiose-Impfstoff (Bio-Shuttle) eingesetzt werden, um den häufigen Einsatz von Medikamenten zu reduzieren.
Shuttle-Programme werden häufig bei der Kokzidiosebekämpfung eingesetzt und liefern zufriedenstellende Ergebnisse. Dabei werden Produkte aus verschiedenen Wirkstoffklassen innerhalb eines Bestandes verwendet. Zum Beispiel wird eine Wirkstoffklasse im Starterfutter, eine andere im Mastfutter und wieder die erste im Endmastfutter eingesetzt, gefolgt von einer Phase ohne Medikamente.
In Rotationsprogrammen werden Antikokzidia zwischen den Beständen gewechselt, nicht innerhalb eines Bestandes.
Fazit
Kokzidiose ist eine der wirtschaftlich bedeutendsten Geflügelkrankheiten, und die Entwicklung von Resistenzen bedroht die Rentabilität der Broilerhaltung. Daher ist die regelmäßige Überwachung der Eimeria-Arten und ihrer Resistenzen entscheidend, um geeignete Kokzidiostatika auszuwählen. Der Einsatz einer wirksamen phytogenen Lösung als strategische und taktische Maßnahme ist vielversprechend – und integrierte Programme werden auch in Zukunft eine wichtige Rolle im Resistenzmanagement spielen.
References:
Abbas, R.Z., D.D. Colwell, and J. Gilleard. “Botanicals: An Alternative Approach for the Control of Avian Coccidiosis.” World’s Poultry Science Journal 68, no. 2 (June 1, 2012): 203–15. https://doi.org/10.1017/s0043933912000268.
Abbas, R.Z., Z. Iqbal, D. Blake, M.N. Khan, and M.K. Saleemi. “Anticoccidial Drug Resistance in Fowl Coccidia: The State of Play Revisited.” World’s Poultry Science Journal 67, no. 2 (June 1, 2011): 337–50. https://doi.org/10.1017/s004393391100033x.
Allen, P. C., and R. H. Fetterer. “Recent Advances in Biology and Immunobiology of Eimeria Species and in Diagnosis and Control of Infection with These Coccidian Parasites of Poultry.” Clinical Microbiology Reviews 15, no. 1 (January 2002): 58–65. https://doi.org/10.1128/cmr.15.1.58-65.2002.
Chapman, H. D. “Biochemical, Genetic and Applied Aspects of Drug Resistance in Eimeria Parasites of the Fowl.” Avian Pathology 26, no. 2 (June 1997): 221–44. https://doi.org/10.1080/03079459708419208.
Chapman, H.D. “Resistance to Anticoccidial Drugs in Fowl.” Parasitology Today 9, no. 5 (May 1993): 159–62. https://doi.org/10.1016/0169-4758(93)90137-5.
Cobaxin-Cárdenas, Mayra E. “Natural Compounds as an Alternative to Control Farm Diseases: Avian Coccidiosis.” Farm Animals Diseases, Recent Omic Trends and New Strategies of Treatment, March 21, 2018. https://doi.org/10.5772/intechopen.72638.
Nazzaro, Filomena, Florinda Fratianni, Laura De Martino, Raffaele Coppola, and Vincenzo De Feo. “Effect of Essential Oils on Pathogenic Bacteria.” Pharmaceuticals 6, no. 12 (November 25, 2013): 1451–74. https://doi.org/10.3390/ph6121451.
Pop, Loredana Maria, Erzsébet Varga, Mircea Coroian, Maria E. Nedișan, Viorica Mircean, Mirabela Oana Dumitrache, Lénárd Farczádi, et al. “Efficacy of a Commercial Herbal Formula in Chicken Experimental Coccidiosis.” Parasites & Vectors 12, no. 1 (July 12, 2019). https://doi.org/10.1186/s13071-019-3595-4.
World Health Organization Technical Report Series No. 296, (1965) pp:. 29.
